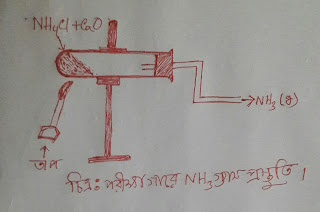
অ্যামোনিয়ার শিল্পোৎপাদনে হেবার প্রণালী মূলনীতি সহ বর্ণনা কর।
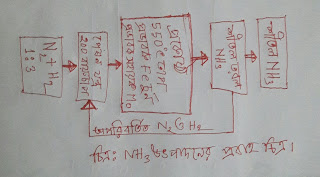
অ্যামোনিয়ার শিল্পোৎপাদনে হেবার প্রণালী মূলনীতি সহ বর্ণনা কর। মূলনীতিঃ উচ্চ তাপমাত্রায় ও উচ্চচাপে 1 মোল নাইট্রোজেন(N₂) গ্যাস ও 3 মোল হাইড্রোজেন(H₂) গ্যাস বিক্রিয়া করে 2 মোল অ্যামোনিয়া(NH₃) গ্যাস উৎপন্ন হয়। N₂(g) + 3H₂(g) <-----> 2NH₃ (g) + 92kj/mol বিক্রিয়াটি উভমুখী, তাপ উৎপাদী এবং আয়তন সংকোচনের মাধ্যমে ঘটে। উৎপাদন প্রণালীর বর্ণনাঃ বিশুদ্ধ নাইট্রোজেন ও হাইড্রোজেনের ১ঃ৩ আয়তনে মিশ্রিত করে 550 ডিগ্রি সেলসিয়াস অত্যানুকুল তাপমাত্রা, 200 বায়ুমন্ডলীয় অত্যানুকুল চাপে, লৌহচূর্ণ (Fe) প্রভাবক ও মলিবডেনাম (Mo) সহায়ক প্রভাবক সম্বলিত প্রকোষ্ঠে চালনা করা হয়। এতে নাইট্রোজেন ও হাইড্রোজেন এর 15% - 20% যুক্ত হয়ে অ্যামোনিয়া গ্যাস উৎপন্ন করে। উৎপন্ন অ্যামোনিয়া ও অপরিবর্তিত নাইট্রোজেন ও হাইড্রোজেন মিশ্রণকে শীতল কুন্ডলীতে চালনা কর হয়। ফলে অ্যামোনিয়া গ্যাস তরলীভূত হয়ে তরল অ্যামোনিয়া পাত্রে জমা হয়। কিন্তু অবশিষ্ট অপরিবর্তিত নাইট্রোজেন ও হাইড্রোজেন গ্যাসকে পুনরায় পেষণ যন্ত্রে সরবরাহ করা হয় এবং নতুন গ্যাস মিশনসহ পুনরায় অ্যামোনিয়া উৎপাদনে ব্যবহৃত হয়।...