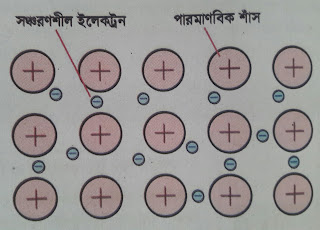
Ionization Energy (আয়নিকরণ শক্তি) কি? আয়নিকরণ শক্তি ঃ গ্যাসীয় অবস্থায় এক মোল কোন পরমাণু থেকে এক মোল ইলেকট্রন অপসারণ করে এক মোল একক ধনাত্বক গ্যাসীয় আয়নে পরিনত করতে যে শক্তির প্রয়োজন হয়, তাকে ঐ মৌলের আয়নিকরণ শক্তি বলে। Na (g) ----------------> Na+ (g) + e 1mol. 1mol. 1mol এখানে 1mol গ্যাসীয় Na (g) পরমাণু হতে এক মোল ইলেকট্রন অপসারণ করে 1mol একক ধনাত্বক গ্যাসীয় সোডিয়াম আয়নে পরিণত করতে 496kj শক্তির প্রয়োজন হয়। একে সোডিয়ামের আয়নিকরণ শক্তি বলে। আয়নিকরণ শক্তি একটি পর্যায়বৃত্ত ধর্ম। যে কোন পর্যায়ের বাম থেকে ডানে গেলে আয়নিকরণ শক্তিরমান ক্রমান্বয়ে বৃদ্ধি পায়। আবার যে কোন গ্রুপের উপর থেকে নিচে গেলে আয়নিকরণ শক্তিরমান ক্রমান্বয়ে হ্রাস পায়। পর্যায় ভিত্তিক সম্পর্কঃ যে কোন পর্যায়ের বাম থেকে ডানে গেলে পরমাণুর আকার ক্রমান্বয়ে হ্রাস পেতে থাকে। এতে পরমাণুর নিউক্লিয়াস কর্তৃক সর্ববহিঃস্হ শক্তিস্তরের প্রতি আকর্ষন বাড়তে থাকার কারণে আয়নিকরণ শক্তির মানও বাড়তে থাকে। যেমন- তৃতীয় পর্যায়ের মৌল Na, Mg, Al, Si, P, S, Cl এদের মধ