লেখচিত্রের সাহায্যে বয়েলের সূত্রের ব্যাখ্য।
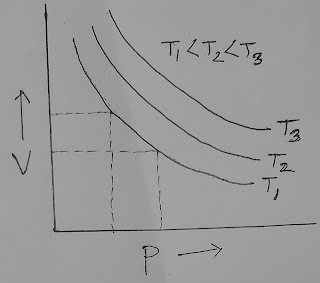
(১) গ্যাসের আয়তন (V) বনাম চাপের (P) লেখচিত্রঃ বয়েলের সূত্র অনুসারে স্হির তাপমাত্রায় নির্দিষ্ট ভরের কোন গ্যাসের উপর বিভিন্ন চাপ প্রয়োগ করলে, বিভিন্ন আয়তন পাওয়া যায়। যা রেকর্ড করা হয়। Y-অক্ষ বরাবর আয়তন এবং X- অক্ষ বরাবর চাপ লেখচিত্র অংকন করলে নিম্নের চিত্রের ন্যায় অধিবৃত্তীয় রেখা পাওয়া যায়। স্থির তাপমাত্রায় প্রক্রিয়াটি সম্পন্ন করে আয়তন বনাম চাপের লেখচিত্র অঙ্কন করলে প্রাপ্ত অধিবৃত্তীয় রেখা সমূহকে আইসোথার্ম বা সমতাপীয় রেখা বলা হয়। চিত্রঃ আয়তন বনাম চাপ লেখচিত্র । (২) গ্যাসের আয়তন (V) বনাম 1/P লেখচিত্রঃ স্থির তাপমাত্রায় কোন নির্দিষ্ট ভরের গ্যাসের আয়তন বনাম প্রযুক্ত চাপের ব্যস্তানুপাতে লেখচিত্র অঙ্কন করলে মূল বিন্দুগামী সরলরেখা পাওয়া যায়। আমরা জানি, বয়েলের সূত্র V α 1/P বা, V = K 1/P [এখানে V = y এবং 1/P = x] হলে- y = mx যা মূল বিন্দুগামী সরলরেখার সমীকরণ। এজন্য গ্যাসের আয়তন (V) কে Y- অক্ষ এবং 1/P কে X- অক্ষ বরাবর লেখচিত্র অংকন করলে মূলবিন্দুগামী সরল রেখা পাওয়া যায়। চিত্রঃ আয়তন (V) বনাম 1/P লেখচিত্র । (৩) গ্যাসের চাপ(P) ও আয়তনের(V) গুণফল ব
