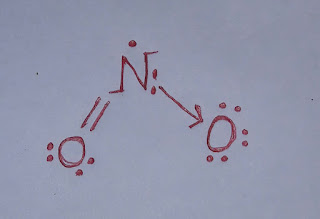
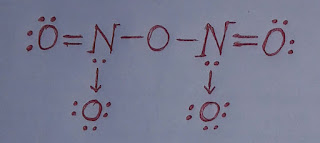
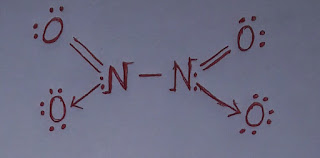
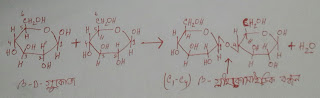
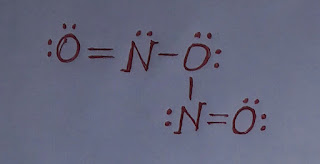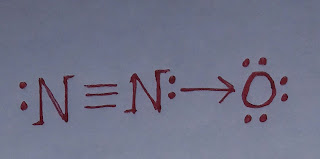NO₂ এর জারণ ধর্ম।
NO₂ এর জারণ ধর্ম। নাইট্রোজেন ডাই-অক্সাইড (NO₂) একটি জারক পদার্থ। এটি অন্যকে জারিত করার সাথে নিজে বিজারিত হয়। নাইট্রোজেন ডাই-অক্সাইডের জারণ ধর্ম নিম্নরূপঃ ১. নাইট্রোজেন ডাই-অক্সাইড, হাইড্রোজেন সালফাইডকে (H₂S) জারিত করে সালফারে (S) পরিণত করে এবং নিজে বিজারিত হয়ে নাইট্রিক অক্সাইড (NO) উৎপন্ন করে। H₂S + NO₂ ----> S + NO + H₂O ২. নাইট্রোজেন ডাই-অক্সাইড, লোহিত তপ্ত লৌহকে (Fe) জারিত করে ফেরাস অক্সাইড (FeO) এবং নিজে বিজারিত হয়ে নাইট্রোজেন (N₂) গ্যাস উৎপন্ন করে। 4Fe + 2NO₂ ----> 4FeO + N₂ ৩. নাইট্রোজেন ডাই-অক্সাইড, উতপ্ত কপারকে (Cu) জারিত করে কপার অক্সাইড (CuO) এবং নিজে বিজারিত হয়ে নাইট্রোজেন (N₂) গ্যাস উৎপন্ন করে। 4Cu + 2NO₂ ----> 4CuO + N₂ কাজেই, উপরোক্ত আলোচনা থেকে বলা যায় NO₂ একটি জারক পদার্থ।